Instituto Tecnológico y de Estudios Superiores de
Monterrey
Campus Puebla
Práctica No. 13
Cinética y equilibrio químico.
Responsable: Mtro.
Víctor Hugo Blanco Lozano
Equipo No. 8
Grupo 2
Integrantes del equipo:
Stephania Díaz Lorenzo
A00397831
Ana Laura Velázquez
Gil
A01325205
Omar Sánchez
Jiménez
A01324800
Jorge Armando Luna
Morales A01099726
Gabriela Rivera
Hernández
A01325193
Objetivos
Como se vio en la práctica pasada, la
cinética es el área fisicoquímica que se encarga de la rapidez de reacción,
cómo cambia la misma bajo condiciones variables y qué eventos moleculares se
efectúan mediante la reacción general. Ahora bien, el objetivo primordial de
esta práctica se centra en analizar aquellos factores que inciden sobre la
velocidad de reacción, así como también entender el concepto de equilibrio químico. Los objetivos son:
·
Determinar
el efecto de la concentración y la temperatura en la velocidad de la reacción.
·
Observar
la respuesta de un sistema en equilibrio ante cambios de concentración, volumen
y temperatura.
·
Calcular
la constante de equilibrio (ley de acción de masas) de una reacción química.
Introducción
En términos generales, toda reacción química tiene dos
características de considerable importancia: la posición de equilibrio y la
velocidad de reacción. El concepto de velocidad de reacción se abordó durante
la práctica pasada, por lo que en el siguiente espacio, se tratará más
extensamente acerca del concepto de equilibrio
químico.
Cuando se habla de “equilibrio”, lo que interesa conocer
es la estabilidad relativa, tanto de los reactivos como de los productos y
cuales son las concentraciones de cada uno en el mismo. El equilibrio químico
también lleva a considerar el término de reacciones
irreversibles, denominado así debido a que se pueden desarrollar en ambos
sentidos de la reacción, es decir, de reactivos a productos y viceversa.
El equilibrio químico es el estado en el
que las actividades químicas de las concentraciones de los reactivos y
productos no tienen ningún cambio neto en el tiempo. Normalmente éste sería el
estado que se produce cuando el proceso químico evoluciona hacia adelante en la
misma proporción que su reacción inversa.
A su vez, gran parte de su estudio se basa en lo que se
conoce como ley de acción de masas, y
en la determinación del valor de la constante de equilibrio, lo cual es de gran
importancia y utilidad para conocer el desempeño de los procesos químicos.
(Martínez,
2011)
Consideraciones teóricas
Cinética química
La cinética química es un área de la
fisicoquímica que se encarga del estudio de la rapidez de reacción, cómo cambia
bajo condiciones variables y qué eventos moleculares se efectúan mediante la
reacción general. La cinética química es un estudio puramente empírico y
experimental.
Cinética de reacciones
El objetivo de la cinética química es medir
las velocidades de las reacciones químicas y encontrar ecuaciones que
relacionen la velocidad de una reacción con variables experimentales.
Se sabe de forma experimental que la
velocidad de una reacción depende mayormente de la temperatura y las
concentraciones de las especies involucradas en la reacción. En las reacciones
simples sólo la concentración de los reactivos afecta la velocidad de reacción
pero en cuestiones más complejas la velocidad también puede depender de la
concentración de uno o más productos. La presencia de un catalizador también
afecta la velocidad de reacción; en este caso puede aumentar su velocidad. De
los estudios de la velocidad de una reacción y su dependencia con todos estos
factores se puede saber mucho acerca de los pasos en detalle para convertir los
reactivos a productos. Esto último es el mecanismo de reacción.
Las reacciones se pueden clasificar
cinéticamente en homogéneas y heterogéneas. Las primeras ocurren en una fase y
las segundas en más de una fase. La reacción heterogénea depende del área de
una superficie, por ejemplo las de un catalizador sólido.
Velocidad de reacción
La rapidez (o velocidad) de reacción está
conformada por la rapidez de formación y la rapidez de descomposición. Esta
rapidez no es constante y depende de varios factores como la concentración de
los reactivos, la presencia de un catalizador, la temperatura de reacción y el
estado físico de los reactivos. Uno de los factores más importantes es la
concentración de los reactivos. Cuanto más partículas existan en un volumen,
más colisiones hay entre las partículas por unidad de tiempo. Al principio la
concentración de reactivos es mayor, también es mayor la probabilidad de que se
den colisiones entre moléculas y la rapidez es mayor. A medida que la reacción
avanza, al ir disminuyendo la concentración de los reactivos, disminuye la
probabilidad de colisión y con ella la rapidez de la reacción. La medida de la
rapidez de reacción implica la medida de la concentración de uno de los
reactivos o productos a lo largo del tiempo, esto es, para medir la rapidez de
una reacción necesitamos medir ya sea la cantidad de reactivo que desaparece
por unidad de tiempo, o bien la cantidad de producto que aparece por unidad de
tiempo.
La rapidez de reacción se mide en unidades de
concentración/tiempo, esto es, en (mol/l)/s es decir moles/(l*s).
Donde VR es la rapidez de reacción,
(-∆CA)
la disminución de la concentración del reactivo en el tiempo ∆t. Esta es la rapidez media de la reacción,
pues todas las moléculas necesitan tiempos distintos para reaccionar.
La velocidad de aparición del producto es
igual a la rapidez de la desaparición del reactivo. De este modo, la ley de la
rapidez se puede escribir de la siguiente forma:
Este modelo necesita otras simplificaciones
con respecto a:
La activación química, es decir, “la
concentración efectiva”.
La cantidad de los reactivos en proporción a
la cantidad de los productos y del disolvente.
La temperatura
La energía de colisión
Presencia de catalizadores
La presión parcial de gases
Orden de reacción
Para cada reacción se puede formular una
ecuación, ésta describe cuántas partículas del reactivo reaccionan entre sí,
para formar una cantidad de partículas del producto.
Para una reacción de la forma:
Esto significa, que dos partículas A colisionan con una partícula B, una partícula C y una partícula D para formar el
producto E.
Sin embargo, la probabilidad que cinco
partículas colisionen y formen un producto intermedio es baja. Realmente, el
producto intermedio es formado por un par de partículas y éste colisiona con
las demás partículas y forma otros productos intermedios hasta formar el
producto E. Por ejemplo:
La descomposición de la reacción principal en
llamadas reacciones elementales y el análisis de éstas nos muestran exactamente
cómo ocurre esta reacción.
Por medio del método experimental o por
premisas se puede determinar la dependencia de la rapidez de las reacciones
elementales con las concentraciones de los componentes A, B, C y D.
El orden de reacción está definido como la
suma de los exponentes de las concentraciones en la ley de la velocidad de la
reacción. Éste es llamado también orden total de reacción, pues el orden
depende del reactivo que se analice. El orden de las reacciones se determina
experimentalmente.
Factores que afectan a la velocidad de las
reacciones
Existen varios factores que afectan la
rapidez de una reacción química: la concentración de los reactivos, la
temperatura, la existencia de catalizadores y la superficie de contacto tanto
de los reactivos como del catalizador. Los catalizadores pueden aumentar o
disminuir la velocidad de reacción.
Temperatura
Por norma general la rapidez de reacción
aumenta con la temperatura porque al aumentarla incrementa la energía cinética
de las moléculas, éstas se mueven más rápido y chocan con mayor frecuencia y
con más energía. El comportamiento de la constante de rapidez o coeficiente con
respecto a la temperatura puede ser descrito a través de la ecuación de
Arrhenius.
Dónde:
k: Constante cinética
(dependiente de la temperatura)
A: Factor pre
exponencial o factor de frecuencia. Refleja la frecuencia de las colisiones.
Ea: Energía de
activación expresada en J/mol*R
R: Constante universal
de los gases su valor es 8.314J*K-1*mol-1
T: Temperatura
absoluta [K]
Al linealizarla se tiene que el logaritmo de
la constate de rapidez es inversamente proporcional a la temperatura como
sigue:
Para un buen número de reacciones química la
rapidez se duplica aproximadamente cada 10 grados centígrados.
La obtención de una ecuación que pueda
emplearse para predecir la dependencia de la rapidez de reacción con las
concentraciones de reactivos es uno de los objetivos básicos de la cinética
química. Esa ecuación, que es determinada de forma empírica recibe el nombre de
ecuación de rapidez. De este modo si consideramos de nuevo hipotéticamente que
la velocidad de reacción “v”
puede expresarse como v=k[A]n[B]m, los términos entre corchetes serán las
molaridades de los reactivos y los exponentes y coeficientes que, salvo en el
caso de una etapa elemental no tienen por qué estar relacionados con el
coeficiente estequiométrico de cada uno de los reactivos. Lo valores de estos
exponentes se conocen como orden de reacción.
Presión
En una reacción química, si existe una mayor
presión, la energía cinética de las partículas va a aumentar y la reacción se
volverá más rápida al igual que en los gases que el aumentar su presión aumenta
también el movimiento de sus partículas y, por tanto, la rapidez de reacción es
mayor.
Luz
La luz es una forma de energía. Algunas
reacciones, al ser iluminadas, se producen más rápidamente, como ocurre en el
caso de la reacción entre el cloro y el hidrógeno. En general, la luz arranca
electrones de algunos átomos formando iones, con lo que aumenta
considerablemente la velocidad de reacción.
La ley de Arrhenius y la energía de
activación
Energía de activación
En 1988, el químico sueco Svante Arrhenius
sugirió que las moléculas deben poseer una cantidad mínima de energía para
reaccionar. Esa energía proviene de la energía cinética de las moléculas que
colisionan. La energía cinética sirve para originar las reacciones, pero si las
moléculas se mueven muy lento, sólo rebotan al chocar con otras moléculas y la
reacción no sucede. Para que reaccionen las moléculas, éstas deben de tener una
energía cinética total que sea igual o mayor que cierto valor mínimo de
energía, llamada energía de activación (Ea). Para que se lleve a cabo la
reacción es necesario también que las moléculas estén orientadas correctamente.
La constante de la velocidad de una reacción (k) depende también de la
temperatura ya que la energía cinética depende de ella. La relación entre k y
la temperatura está dada por la ecuación de Arrhenius:
Equilibrio Químico
El equilibrio químico es el estado en el que las
actividades químicas de las concentraciones de los reactivos y productos no
tienen ningún cambio neto en el tiempo. Normalmente éste sería el estado que se
produce cuando el proceso químico evoluciona hacia adelante en la misma
proporción que su reacción inversa. La velocidad de reacción de las reacciones
directa e inversa por lo general no son cero, sin embargo, son iguales, no hay
cambios netos en cualquiera de las concentraciones de los reactivos o
productos. Este proceso se denomina equilibrio dinámico. El concepto de
equilibrio químico fue desarrollado después de que Bertholle (1803) encontrase
que algunas reacciones químicas son reversibles. Para que una reacción, tal
como:
pueda estar en equilibrio, las velocidades de reacción directa e inversa tiene que ser iguales. Esta ecuación química con flechas apuntando en ambas direccione es para indicar el equilibrio, A y B son las especies químicas que reaccionan, S y T son los productos y α, β, δ y τ son los coeficientes estequiométricos de los reactivos y los productos.
pueda estar en equilibrio, las velocidades de reacción directa e inversa tiene que ser iguales. Esta ecuación química con flechas apuntando en ambas direccione es para indicar el equilibrio, A y B son las especies químicas que reaccionan, S y T son los productos y α, β, δ y τ son los coeficientes estequiométricos de los reactivos y los productos.
Desarrollo
De acuerdo a la reacción global que se llevará a cabo:
1.- Se prepararán 3 diferentes experimentos, mezclando agua
destilada, solución de vitamina C, solución de yodo, solución de peróxido de
hidrógeno y una solución de almidón al 0.3%, los cuales describen a
continuación.
2.-El experimento 1 se realiza etiquetando dos matraces
Erlenmeyer de 250 ml, uno con A y otro B, los cuales deberás preparar según la
tabla siguiente:
 |
| Soluciones preparadas |
Experimento 1
Experimento 1
|
Agua (ml)
|
Vitamina C (ml)
|
Solución de I2
(ml)
|
Volumen total (ml)
|
Matraz A
|
62
|
4
|
4
|
70
|
Experimento 1
|
Agua (ml)
|
Peróxido al 3%
(ml)
|
Almidón al 3%
(ml)
|
Volumen total (ml)
|
Matraz B
|
60
|
15
|
2
|
77
|
a) Para el matraz A se midieron las cantidades indicadas en
la tabla en el siguiente orden: 62 ml de agua, 4 ml de vitamina C, 4 ml de I2,
usando una pipeta para cada reactivo a excepción del agua (para medir el
agua se usó una probeta) con la finalidad de no mezclar las sustancias entre sí
y prevenir que la reacción empezara antes de tiempo.
b) El mismo procedimiento se siguió para el contenido del
matraz B usando sus respectivas probetas y pipetas para cada reactivo.
c) El matraz A se sumergió en un vaso de precipitado de 600
ml con 1/3 de agua a temperatura ambiente. Se introdujo un agitador magnético y
un termómetro dentro de él. Todo el sistema se colocó sobre una mufla.
d) El matraz B se sumergió en un vaso de precipitados de 250
ml lleno a 1/3 de su capacidad de agua a temperatura ambiente y se le introdujo
un termómetro.
e) se comprobó que ambos sistemas estuvieran a la misma
temperatura.
f) una vez igualadas las temperaturas de los sistemas, se
inició la agitación magnética del matraz A.
g) Se agregó el contenido del matraz B al matraz A, al mismo
tiempo que se inició el conteo con el cronómetro.
h) El tiempo se detuvo una vez que se detectó el cambio de
coloración en el contenido del matraz A. Los resultados se anotaron en la
bitácora. Todo el experimento ocurrió a temperatura ambiente.
 |
| Experimento 1 |
RESULTADOS:
Determinación del orden de reacción y la energía de activación
Registro de datos
Experimento 1
Temperatura ambiental de matraces: A y B 24 ºC
Registro del tiempo obtenido: 22 min
V inicial= ([Vitamina C]/t reacción)
V inicial = [0.0946 M]/ (0.05*79200)
V inicial = 0.000023889 M/L*s
Cuestionario
. Defina los siguientes conceptos
.
a) Cinética Química
se conoce como cinética química a la rama de la química
que se encarga de la medición de la velocidad o rapidez con la que una reacción
química se realiza. También se le conoce como el cambio en la concentración de
un reactivo o un producto con respecto al tiempo.(Chang, 2010)
.
b) Velocidad de reacción
se conoce como velocidad de reacción al cambio que se
produce en la concentración de los reactivos o productos conforme va pasando el
tiempo y la reacción se va llevando a cabo. Existen algunos factores que pueden
intervenir en la reacción y alterar la velocidad tales como son la temperatura,
la presencia de un catalizador y el estado físico de los reactivos. Conforme la
reacción se va realizando la velocidad de reacción va disminuyendo ya que
también la concentración del reactivo se disminuye. ( Universidad de Alcalá
2010)
.
c) Orden global de reacción
se le conoce como orden global de reacción a la suma de
los coeficientes a los que se encuentran elevadas las concentraciones en la ley
de velocidad: V=K ([A]^m) ([B]^n). En este caso el orden global de reacción
estaría dado por m+n. (Chan, 2010)
.
d) Equilibrio Químico
Se dice que una reacción química se encuentra en
equilibrio químico cuando la reacción presenta un proceso reversible y un
inverso y las rapideces de ambos
procesos se igualan y sus concentraciones permanecen constantes. El proceso
reversible es el proceso en el que la reacción forma un producto y el proceso
inverso es en el cual las moléculas de producto reaccionan y forman reactivo.
Una característica del equilibrio químico es que es un proceso dinámico ya que se da la
participación tanto de reactivos como de productos.(Chang, 2010)
2.-Menciona 3 factores que afecten la velocidad de
reacción
la presencia de catalizadores, la temperatura de la
reacción, el estado físico de los reactivos y sus concentraciones.
3.-En un estudio cinético de la reacción:
2SiO(g) + O2(g) ----- 2SiO(g)
Se obtuvieron los siguiente datos para las velocidades iniciales de la
reacción.
No experimento
|
Concentraciones
iniciales M
|
Velocidad
inicial m/s
|
|
SiO
|
O2
|
||
Exp.1
|
0.0125
|
0.0253
|
0.0281
|
Exp.2
|
0.0250
|
0.0253
|
0.112
|
Exp.3
|
0.025
|
0.0506
|
0.0561
|
A)
Obtenga la ley de la
velocidad para esta reacción
Velocidad=k[Sio]^2[O2]^1
B) Obtenga la
constante de velocidad para esta reacción
K=
0.0281\([0.0253]^2 [0.0125]^1)
K=3512.006
4.- La siguiente reacción hipotética A es de primer
orden, tiene un periodo de vida media de 123 minutos a 15 grados C si se inicia
con una concentración de 0.5 M de A, contesta lo siguiente:
A) ¿Cuál es el
valor de la constante de velocidad?
Rapidez= 0.5/7380= 6.77x10^ -5
K=rapidez/ [0.5M]=1.3550x10^-4
B)
¿Cuánto tiempo se
requiere para que 0.5 M de A se descomponga hasta que sólo quede el 20%?
Incremento en el
tiempo= incremento[A]/ Rapidez
0.5-0.1/6.77x10^-5=5908.4
5908.4 segundos
deben de transcurrir
Conclusión
A lo largo de la práctica se trabajó con el concepto de equilibrio químico y con todos aquellos factores
acerca de la velocidad de reacción que se deben medir y analizar para
comprender mejor el proceso que se está llevando a cabo durante la misma. A su
vez, el trabajo experimental realizado durante el laboratorio también ayudó a
entender y discernir acerca del cálculo de la constante de equilibrio y su
efecto en el desarrollo de las reacciones químicas.
A través de la práctica, se pudo observar y
analizar los cambios de color ocurridos en las reacciones que se estuvieron
trabajando y el tiempo en que ocurrían los mismos. Asimismo, se logró comprobar
el efecto que la concentración y la temperatura pueden tener en la velocidad de
la reacción, y observando los cambios ocurrentes
en un sistema en equilibrio ante variaciones de concentración, volumen y
temperatura.
Referencias
Chang,
R. Química. Décima edición. Mc Graw
Hill, 2010, China
Facultad
de farmacia. Universidad de Alcalá.
Velocidades y mecanismos de las reacciones químicas. Rescatado el 27 de
abril de 2010 :
http://www.slideshare.net/tango67/velicidades-y-mecanismos-de-las-reacciones-qumicas
Martínez, E. (2011).
Velocidad de reacción y equilibrio químico. Temas selectos de Química I
(pp. 107-108). México, D.F.: CENGAGE Learning .


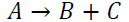






No hay comentarios:
Publicar un comentario